Dialogue immuno-métabolique dans l’obésité et ses cormobidités
Équipe 3 – INSERM U1011 – Université de Lille – CHU Lille – Institut Pasteur de Lille

Présentation
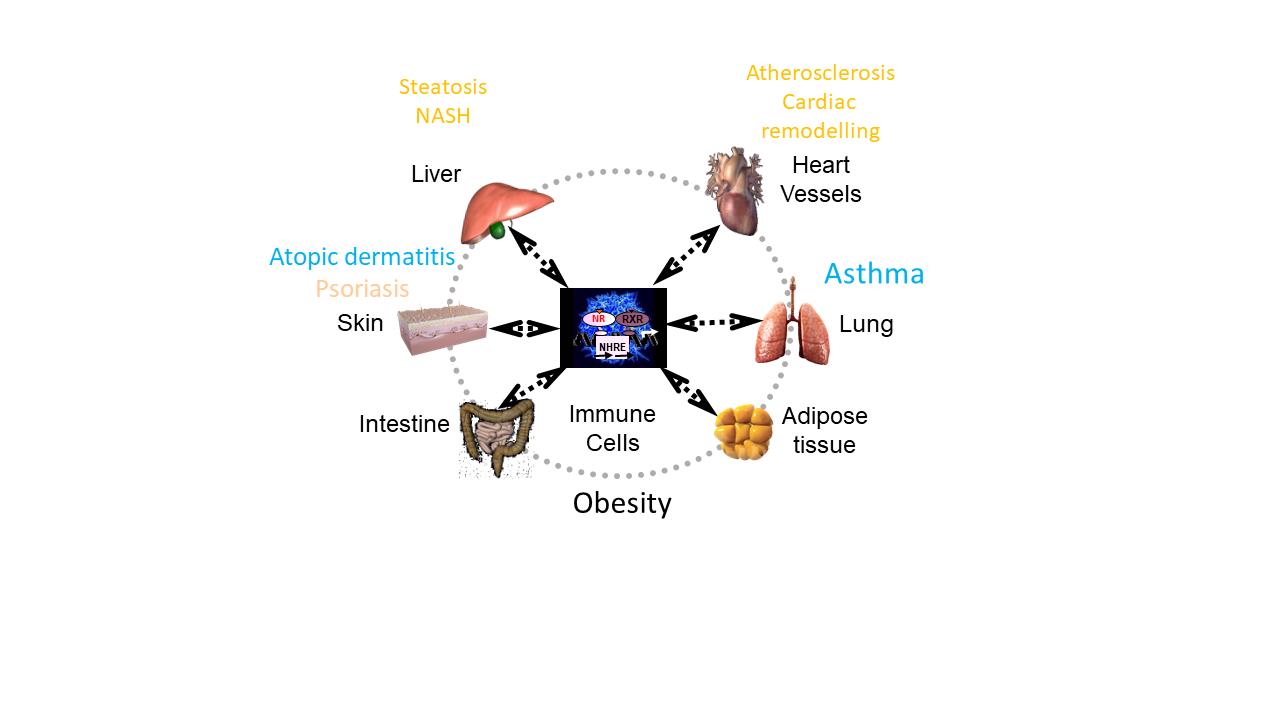
Les systèmes immuno-inflammatoire et métabolique sont étroitement liés, comme le révèlent les comorbidités fréquentes entre maladies (auto)inflammatoires ou (auto)immunes (asthme, psoriasis…) et les pathologies métaboliques et leurs complications cardiovasculaires. Les cellules immunitaires jouent un essentiel dans des pathologies jadis considérées comme des maladies purement métaboliques. A l’inverse, les cellules immunitaires dépendent du métabolisme pour leurs apports énergétiques. Aussi, les pathologies métaboliques ont un impact sur le métabolisme des cellules immunitaires et donc sur leurs fonctions. Les récepteurs nucléaires sont des régulateurs transcriptionnels qui contrôlent les processus immunitaires et métaboliques et sont des cibles thérapeutiques de choix. Nos recherches visent à identifier et élucider les clés du dialogue immuno-métabolique, et notamment la contribution des récepteurs nucléaires exprimés par les cellules immunitaires dans différents contextes pathophysiologiques liés au métabolisme (obésité, diabète de type 2, athérosclérose, NAFLD/NASH…) et à ses comorbidités.
Actus
- Découverte sur la manière dont les acides gras de l’environnement métabolique modulaient la réponse immune innée par l’activation conjointe de l’UPR et le déclenchement d’une réponse de stress intégrée (IRS) spécifique et montré comment ceux-ci exacerbaient le psoriasis (Mogilenko et al., Cell, 2019).
- Mise en evidence une signature transcriptomique et cellulaire spécifique de la transition entre stéatose bénigne et NASH chez l’homme et dans un modèle préclinique avec les sous-populations de cellules dendritiques cDC et les lymphocytes T CD8 cytotoxiques comme éléments majeurs (Haas, et al., Nature Metabolism, 2019).
- Démonstration du rôle régulateur des récepteurs nucléaires PPARa et d dans la septicémie et l’anaphylaxie (Wawrzyniak et al., JACI, 2015, Paumelle et al., Hepatol, 2019).
- Identification des cellules lymphoïdes innées (ILC) comme des contributrices majeures dans l’aggravation de l’asthme allergique par l’obésité (Everaere et al., JACI, 2016).
- Découverte du rôle essentiel de l’axe CX3CL1-CX3CR1 axis pour la fonction des lymphocytes T CD4 inflammatoires dans l’asthme allergique et la dermatite atopique (Mionnet et al., Nature Medicine, 2010, Staumont-Salle et al., Exp. Med, 2014).
- Création du Plateau d’Immuno- Phénotypage Métabolique (PIM, U1011-EGID) doté d’équipements de pointe en cytométrie de flux et de masse (Aria X20, Influx, Helios).
Projet transversal
 Modulation de l’athérosclérose et de l’infection par le virus de l’influenza par une souche atténuée de Bordetella pertussis (BPZE1)
Modulation de l’athérosclérose et de l’infection par le virus de l’influenza par une souche atténuée de Bordetella pertussis (BPZE1)
Collaboration : Dr. S Cauchy et C. Locht, Institut Pasteur de Lille
Membres
David DOMBROWICZ
DR2 Inserm, responsable d’équipe
Numéro ORCID : 0000-0002-0485-8923
Laurent L’HOMME
Post-doc
Johanna HOOGERLAND
Post-doc
Artemii NIKITIN
Post-doc
Sébastien FLEURY
Ingénieur d’Etudes, Inserm
Marie-Laure JOSEPH
Technicienne de recherche, IPL
Olivier MOLENDI-COSTE
Ingénieur de recherche, Inserm
Samuel PIC
Ingénieur d’Etudes, Univ Lille
Laurent PINEAU
Ingénieur de Recherche, IPL
Sandrine QUEMENER
Ingénieur d’Etudes, Univ Lille
Valentine GUINOT
Étudiante en thèse
Pelin SERMIKLI
Post-doc
Marie BICHAREL-LECOMTE
Master 2
Publications
Mogilenko, D.A., Haas, J.T., L’Homme, L., Fleury, S., Quemener, S., Levavasseur, M., Becquart, C., Wartelle, J., Bogomolova, A., Pineau, L., Molendi-Coste, O., Lancel, S., Dehondt, H., Gheeraert,C. Melchior, A., Dewas, C., Nikitin, A., Pic, S., Rabhi, N., Annicotte, J.-S, Oyadomari, S., Velasco-Hernandez, T., Cammenga, J., Foretz, M., Viollet, B., Vukovic, M., Villacreces, A., Kranc, K., Carmeliet, P., Marot, G., Boulter, A., Tavernier, S., Berod, L., Longhi, M. P., Paget, C., Janssens, S., Staumont-Sallé, D§., Aksoy, A§., Staels, B§., and D. Dombrowicz (2019).
Metabolic and Innate Immune Cues Merge into a Specific Inflammatory Response via the UPR.
Cell 177, 1201-1216 e1219l (avec éditorial). Avancée de l’Inserm 2019
Haas, J.T. !§, Vonghia§, L., Mogilenko§, D.A., Verrijken, A., Molendi-Coste, O., Fleury, S., Deprince, A., Nikitin, A., Woitrain, E., Ducrocq-Geoffroy, L, Pic, S., Derudas, B., Dehondt, H., Gheeraert, C., Van Gaal, L., Driessen, A., Lefebvre, P., Staels B*, Francque S* and D. Dombrowicz* (2019).
Transcriptional network analysis implicates altered hepatic immune function in NASH development and resolution.
Nature Metabolism 1, 604-614.
Paumelle, R., Haas, J.T., Hennuyer, N., Bauge, E., Deleye, Y., Mesotten, D., Langouche, L., Vanhoutte, J., Cudejko, C., Wouters, K., Hannou SA, Legry V, Lancel S, Lalloyer F, Polizzi A, Smati S, Gourdy P, Vallez E, Bouchaert E, Derudas B, Dehondt H, Gheeraert C, Fleury S, Tailleux A, Montagner A, Wahli W, Van Den Berghe G, Guillou H, Dombrowicz*, D. and B. Staels* (2019).
Hepatic PPARa is critical in the metabolic adaptation to sepsis.
J Hepatol 70, 963-973.
Everaere, L., S. Ait-Yahia, O. Molendi-Coste, H. Vorng, S. Quemener, P. LeVu, S. Fleury, E. Bouchaert, Y. Fan, C. Duez, P. de Nadai, B. Staels, D. Dombrowicz*, and A. Tsicopoulos*. 2016.
Innate lymphoid cells contribute to allergic airway disease exacerbation by obesity.
J Allergy Clin Immunol . 138,1309-1318 e11 (avec editorial).
Julia, V., Macia, L., and Dombrowicz, D. (2015).
The impact of diet on asthma and allergic diseases.
Nat Rev Immunol 15, 308-322.
Mots-clés
Inflammation ; Immuno-metabolisme ; Système immunitaire ; Maladies métaboliques et cardiovasculaires ; NAFLD/NASH ; Acides biliaires ; Cytométrie ; Récepteur nucléaire ; Psoriasis ; Allergie