Biologie structurale intégrative
Équipe 4 – UMR1167 – Inserm – Université de Lille – CHU Lille – Institut Pasteur de Lille
Présentation
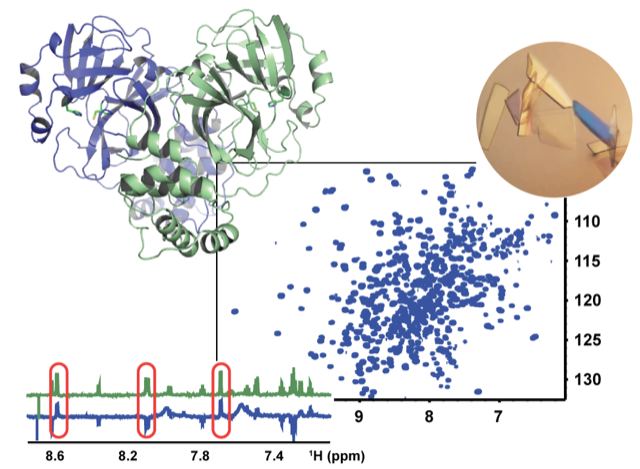
L’équipe “Biologie structurale intégrative” étudie les bases structurales et les mécanismes moléculaires qui contrôlent la fonction biologique des protéines et l’incidence de leur dérégulation dans les pathologies humaines. L’intérêt se porte en particulier sur les protéines intrinsèquement désordonnées. Celles-ci présentent des caractéristiques particulières telles que de nombreuses modifications post-traductionnelles ou des régions riches en proline qui vont en moduler leur fonction, en particulier leurs interactions, et/ou leur sensibilité à l’agrégation dans les protéinopathies.
L’équipe aborde ces questions en utilisant des approches biophysiques multidisciplinaires et intégrées comme la spectroscopie de résonance magnétique nucléaire, la cristallographie aux rayons X, ainsi que la cryo-microscopie électronique.
La recherche est essentiellement fondamentale mais nous restons attentifs à l’utilisation de ces connaissances pour la caractérisation de nouvelles cibles thérapeutiques, l’évaluation du potentiel thérapeutique de composés divers, de petites molécules aux nanobodies (très petits anticorps), et l’étude du mode d’action de composés actifs.
Actus
- 2019 ANR CREST JCJC, Robert Schneider,
Les canaux tensiodépendants (CTs) permettent la signalisation dans les cellules via un courant éléctrique. L’état au repos de leurs domaines sensibles au voltage (DSV) reste inconnu, puisqu’il est uniquement adopté en présence du potentiel de repos de la membrane. CREST propose d’aborder ce problème par une approche novatrice : établir un potentiel de Donnan à travers la membrane de liposomes via la présence asymétrique de polyélectrolytes imperméables, et d’étudier des CTs reconstitués dans ces liposomes par RMN de l’état solide.
- 2020 ANR URANUS JCJC, Davy Sinnaeve.
Comprendre la fonction des biopolymères flexibles tels que les protéines intrinsèquement désordonnées, des glycanes ou des oligonucléotides requiert l’étude de leurs ensembles conformationnels. La RMN en solution est la technique de choix pour définir ces ensembles. Néanmoins, le moyennage rapide des conformations sur l’échelle de temps de la RMN réduit la dispersion de déplacements chimiques, ce qui résulte, en tenant de plus compte des nombreux couplage 1H-1H, en une superposition des signaux. Ceci entrave le recueil de données RMN du 1H. La flexibilité complique aussi beaucoup l’interprétation des données. URANUS présente une stratégie générale pour résoudre ces deux problèmes pour tout type de biopolymère. A moyen terme, une boîte à outils de ces techniques, généralement applicable à tout biopolymère, sera mise à disposition.
- Le Labex Distalz, dont l’équipe fait partie, « Développement de stratégies innovantes pour une approche transdisciplinaire de la maladie d’Alzheimer » est renouvelé pour la période 2020-2025. Le Labex est coordonné par le Prof. Philippe Amouyel. L’une des réalisations majeures de DISTALZ est la complémentarité entre ses huit équipes : les généticiens sont en contact avec des biologistes moléculaires et cellulaires et tous les trois sont liés à des biophysiciens, cliniciens, psychologues et éthiciens qui travaillent ensemble au quotidien. Cela permet d’unir leurs forces dans un laboratoire unique avec un programme de recherche commun pour surmonter certains obstacles de la recherche sur la maladie d’Alzheimer, accélérer la découverte de solutions innovantes à partir de nouvelles cibles potentielles de médicaments, et traduire ces résultats en réponses socialement et éthiquement appropriées.
Projet transversal
 Xavier Hanoulle a pris part aux efforts transversaux du campus Pasteur contre la COVID-19, et a reçu un support de l’Isite pour son projet 3CLPro.
Xavier Hanoulle a pris part aux efforts transversaux du campus Pasteur contre la COVID-19, et a reçu un support de l’Isite pour son projet 3CLPro.
Dans le cadre de la pandémie liée au SARS-CoV-2, ce projet vise à identifier rapidement des molécules ou fragments qui pourraient inhiber la protéase 3CLpro du SARS-CoV-2. La protéase 3CLpro est une protéine non-structurale du coronavirus qui est essentielle dans son cycle de réplication. Grâce à son activité enzymatique, elle mature (clive) les polyprotéines pp1a et pp1b. Les protéines matures constitueront alors les complexes de réplication. La 3CLpro représente par conséquent une cible thérapeutique. Les molécules pouvant inhiber la 3CLpro peuvent soit se fixer au niveau de son site actif, soit au niveau de son interface de dimérisation puisque qu’il a été montré que cette enzyme est active sous forme de dimère. Dans ce projet nous proposons de réaliser un criblage de molécules/fragments sur la 3CLpro du SARS-CoV-2 par Résonance Magnétique Nucléaire (RMN). La réalisation de ce projet reposera sur des librairies de fragments disponibles au sein de l’U1177 (B. Desprez, Institut Pasteur de Lille). Les molécules identifiées, in vitro, au cours du projet seront testées dans un test d’activité in vitro puis dans un sytème cellulaire afin de valider leur potentielle efficacité sur le SARS-CoV-2 (J. Dubuisson, Centre d’Infection et d’Immunité de Lille, Institut Pasteur de Lille).
Membres
Isabelle LANDRIEU
DR2 CNRS, responsable d’équipe
Marc AUMERCIER
DR2 CNRS
Laurent COUTTE
MCU Univ Paris XI
Xavier HANOULLE
DR2 CNRS
Didier MONTE
CRHC CNRS
Robert SCHNEIDER
MCU Univ Lille
Davy SINNAEVE
CRCN CNRS
Caroline SMET-NOCCA
MCU Univ Lille, CNRS
Alexis VERGER
CRCN CNRS
Vincent VILLERET
DR1 CNRS
François-Xavier CANTRELLE
IGN UnivLille
Bernard CLANTIN
IR1 CNRS
Frédérique DEWITTE
IECN CNRS
Zoé LENS
IECN CNRS
Justine MORTELECQUE
IE CNRS, CDD
Guillaume ROUAULT
IE CNRS, CDD
Emmanuelle BOLL
TCS CNRS
Elian DUPRE
Post-doc Univ Lille
Orgeta ZEJNELI
Étudiante en thèse, cotutelle Luc Buée
Danai MOSCHIDI
Étudiante en thèse
Publications
Monté D, Clantin B, Dewitte F, Lens Z, Rucktooa P, Pardon E, Steyaert J, Verger A, Villeret V.
Crystal structure of human Mediator subunit MED23.
Nat Commun. 2018 Aug 23;9(1):3389. doi: 10.1038/s41467-018-05967-y.
Dujardin M, Madan V, Gandhi NS, Cantrelle FX, Launay H, Huvent I, Bartenschlager R, Lippens G, Hanoulle X.
Cyclophilin A allows the allosteric regulation of a structural motif in the disordered domain 2 of NS5A and thereby fine-tunes HCV RNA replication.
J Biol Chem. 2019 Aug 30;294(35):13171-13185. doi: 10.1074/jbc.RA119.009537.
Sinnaeve D, Ilgen J, Di Pietro ME, Primozic JJ, Schmidts V, Thiele CM, Luy B.
Probing Long-Range Anisotropic Interactions: a General and Sign-Sensitive Strategy to Measure 1 H-1 H Residual Dipolar Couplings as a Key Advance for Organic Structure Determination.
Angew Chem Int Ed Engl. 2020 Mar 23;59(13):5316-5320. doi: 10.1002/anie.201915278.
Despres C, Di J, Cantrelle FX, Li Z, Huvent I, Chambraud B, Zhao J, Chen J, Chen S, Lippens G, Zhang F, Linhardt R, Wang C, Klärner FG, Schrader T, Landrieu I, Bitan G, Smet-Nocca C.
Major Differences between the Self-Assembly and Seeding Behavior of Heparin-Induced and in Vitro Phosphorylated Tau and Their Modulation by Potential Inhibitors.
ACS Chem Biol. 2019 Jun 21;14(6):1363-1379. doi: 10.1021/acschembio.9b00325.
Wolter M, de Vink P, Neves JF, Srdanović S, Higuchi Y, Kato N, Wilson A, Landrieu I, Brunsveld L, Ottmann C.
Selectivity via Cooperativity : Preferential Stabilization of the p65/14-3-3 Interaction with Semisynthetic Natural Products.
J Am Chem Soc. 2020 Jul 8;142(27):11772-11783. doi: 10.1021/jacs.0c02151.
Mots-clés
Structure des protéines ; Interactions protéine-protéine ; Protéines intrinsèquement désordonnées ; Modifications post-traductionelles des protéines ; Interactions ligands-protéines ; Résonance magnétique nucléaire ; Cristallographie ; Recherche transdisciplinaire
Contact équipe
Isabelle Landrieu
Directeur de recherche CNRS
isabelle.landrieu@univ-lille.fr
03 20 87 73 02 ; 03 62 53 17 12