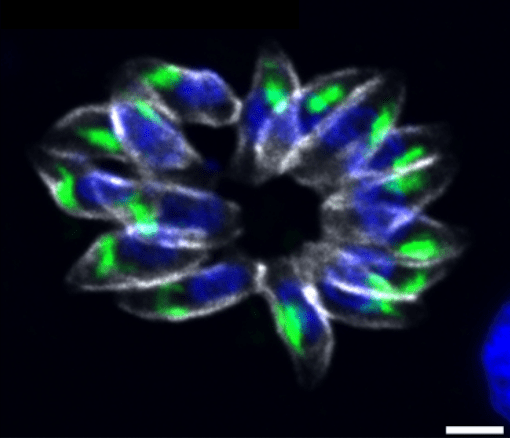
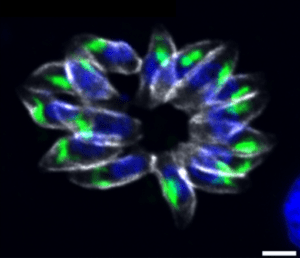
Biologie des parasites Apicomplexes : facteurs régulant la croissance, la différenciation et la virulence
INSERM U1019 – CNRS UMR9017 – Université de Lille – CHU Lille – Institut Pasteur de Lille

Présentation
Les parasites apicomplexes Plasmodium et Toxoplasma gondii, agents responsables du paludisme et de la toxoplasmose respectivement, continuent de représenter une menace pour la santé publique et de peser lourdement sur le développement socio-économique de nombreuses régions du monde. Nos recherches actuelles se concentrent sur les axes suivants : 1) comprendre le rôle des facteurs de transcription et de la régulation épigénétique de l’expression des gènes dans le contrôle de la prolifération et de la différenciation de T. gondii ; 2) examiner les phénomènes de phosphorylation réversibles en mettant l’accent sur les questions liées aux phosphatases et à leur régulation chez Plasmodium et T. gondii et 3) élucider les mécanismes moléculaires régulant la sécrétion de facteurs de virulence par T. gondii et caractériser leur impact sur les réponses immunitaires de l’hôte. Enfin, nous nous appuyons sur notre connaissance de la biologie de Plasmodium et T. gondii afin de découvrir de nouveaux composés qui seraient actifs contre ces parasites.
Actus
- Régulation des gènes : Démonstration que la coopération de deux facteurs de transcription ApiAP2 est cruciale pour la régulation de l’expression des facteurs de virulence chez le parasite apicomplexe T. gondii. L’équipe a également démontré qu’un autre facteur de la famille des ApiAP2 est un régulateur clé de la division chez ce parasite. En effet, il contrôle non seulement la formation des parasites filles mais aussi l’expression d’autres facteurs de transcription impliqués dans le déroulement du cycle de division (Lesage KM et al. 2018, Khelifa AS et al 2021).
- Modifications post-traductionnelles : Les études sur les phénomènes de phosphorylation réversible chez Plasmodium ont révélé que les régulateurs de la Protéine Phosphatase 1, une sérine/thréonine phosphatase, sont aussi essentiels pour le parasite que la sous-unité catalytique de l’enzyme. En outre, l’interférence avec les interactions régulateurs/sous-unité catalytique conduit à l’inhibition de la croissance de P. falciparum in vitro (Hollin T et al. 2019, Gnangnon B 2019, Khalife J et al. 2021).
- La sécrétion de l’effecteur parasitaire et les réponses immunitaires de l’hôte : Démonstration du rôle clé de la petite GTPase TgRab11A dans la sécrétion des protéines contenues dans les granules denses, incluant notamment des facteurs de virulence essentiels pour la survie du parasite au sein des cellules hôtes. De plus, nous avons récemment décrit que l’induction de la réponse protéique dépliée (UPR) de l’hôte dans les cellules dendritiques infectées joue un rôle protecteur essentiel contre l’infection par T. gondii (Venugopal K et 2020, Poncet A et al. 2021).
- Découverte de médicaments: Un projet sur la recherche de nouveaux médicaments anti-parasitaires ciblant les modifications épigénétiques (consortium A-ParaDDisE, projet financé par l’Europe), a permis d’identifier 3 nouvelles molécules comme puissants antipaludiques (Bouchut A et al. 2019).
Projets transversaux
 Conséquences de l’infection par T. gondii sur la fonction des neurones.
Conséquences de l’infection par T. gondii sur la fonction des neurones.
- gondii est capable d’infecter les neurones dans le cerveau d’individus immunocompétents. En l’absence de médicament actuellement disponible pour éliminer ces parasites dans le cerveau, l’infection par T. gondii peut donc influencer l’activité des neurones, et à long terme affecter le système nerveux central des hôtes immunocompétents. On sait depuis longtemps que T. gondii influence l’activité des neurones, mais comment ce parasite manipule le neurone et comment le neurone réagit à l’infection reste encore à élucider. En étroite collaboration avec l’équipe du Dr JC Lambert (U1067), l’équipe étudie l’impact direct de l’infection du parasite sur le neurone. Ce projet a été soutenu par le CPER CTRL 19.
 Conséquences de l’inflammation cérébrale causée par le parasite Toxoplasma gondii sur l’exacerbation des processus pathologiques lors des Tauopathies
Conséquences de l’inflammation cérébrale causée par le parasite Toxoplasma gondii sur l’exacerbation des processus pathologiques lors des Tauopathies
La toxoplasmose latente est corrélée à l’établissement d’une inflammation chronique de bas-grade dans le système nerveux central, qui est notamment caractérisée par l’activation des cellules immunitaires résidentes : les astrocytes et microglies. Ces cellules une fois activées, induisent la voie des kynurénines qui génère des métabolites neurotoxiques pouvant être à l’origine d’une altération neuronale. En collaboration avec le laboratoire du Dr David Blum (UMR-S1172 “Alzheimer & Tauopathies”) qui a développé un modèle murin de tauopathie, le projet vise à étudier si la toxoplasmose chronique module la voie KP et ainsi exacerbe la progression de la pathologie Tau.
Membres
Jamal KHALIFE
DR CNRS, responsable d’équipe
Numéro ORCID : 0000-0002-4359-8976
Sabrina MARION
MCU, Univ Lille
Numéro ORCID : 0000-0001-7824-955X
Christine PIERROT
CR IPL
Numéro ORCID : 0000-0002-6835-6789
Mathieu GISSOT
DR CNRS
Numéro ORCID : 0000-0003-0047-8189
El Moukhtar ALIOUAT
Professeur, Univ Lille
Numéro ORCID : 0000-0003-2905-7126
Emmanuel ROGER
MCU, Univ Lille
Numéro ORCID : 0000-0002-0982-0369
Caroline DE WITTE
Ingénieure CE, IPL
Véronique PEUCELLE
Ingénieure CE, IPL
Thomas MOUVEAUX
Ingénieur IE, CNRS
Tom BOISSAVY
Ingénieur AI
Sylia CHEHADE
Étudiant en thèse
Asma-Sarah KHELIFA
Étudiant en thèse
Cécilia N’GUESSAN
Post-doc
Claudianne LAINE
Étudiante en thèse
Hala MANSOUR
Étudiant en thèse
Lola GURGOGLIONE
Étudiant Master 2, Univ Tours
Mohammed Amir KEZAI
Post-doc
Publications
Bouchut A et al. 2019.
Identification of novel quinazoline derivatives as potent antiplasmodial agents.
European Journal of Medicinal Chemistry; 161
Venugopal K et 2020.
Rab11A regulates dense granule transport and secretion during Toxoplasma gondii invasion of host cells and parasite replication.
PLoS pathogens; 16(5).
Khalife J et al. 2021.
The Multifaceted Role of Protein Phosphatase 1 in Plasmodium.
Trends in parasitology; 37 (2).
Khelifa AS et al 2021.
TgAP2IX-5 is a key transcriptional regulator of the asexual cell cycle division in Toxoplasma gondii.
Nature Communications; 12 (116).
Poncet A et al. 2021.
The UPR sensor IRE1α promotes dendritic cell responses to control Toxoplasma gondii infection.
EMBO Reports In press.
Mots-clés
Parasites Apicomplexes ; Malaria ; Toxoplasmose ; Plasmodium ; T. gondii
Contact équipe
Jamal Khalife
Responsable de l’équipe
jamal.khalife@pasteur-lille.fr
03 20 87 79 68
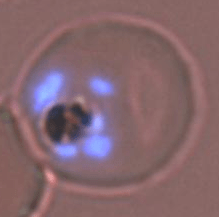
Un globule rouge infecté par P. falciparum.